Die neuroprotektive Wirkung von Cannabis
Im Anschluss an unseren kürzlich erschienenen Artikel über den Zusammenhang zwischen Cannabisgebrauch und Schlaganfall untersuchen wir nun die Rolle der Cannabinoide bei der Linderung von Gehirnschäden, die durch traumatische (durch Unfälle verursachte) Hirnverletzungen und ischämische Schlaganfälle hervorgerufen werden. Es gibt immer mehr Hinweise darauf, dass die vielfältigen Eigenschaften der Cannabinoide großes therapeutisches Potenzial besitzen.
Im Anschluss an unseren kürzlich erschienenen Artikel über den Zusammenhang zwischen Cannabisgebrauch und Schlaganfall untersuchen wir nun die Rolle der Cannabinoide bei der Linderung von Gehirnschäden, die durch traumatische (durch Unfälle verursachte) Hirnverletzungen und ischämische Schlaganfälle hervorgerufen werden. Es gibt immer mehr Hinweise darauf, dass die vielfältigen Eigenschaften der Cannabinoide großes therapeutisches Potenzial besitzen.
Antioxidative & entzündungshemmende Eigenschaften
In den vergangenen Jahren sind die antioxidativen und entzündungshemmenden Eigenschaften der verschiedenen Cannabinoide bekannt geworden, und wir beginnen nun auch zu verstehen, welche Funktion sie bei der Regulierung der Neurotransmission (Erregungsübertragung zwischen Nervenzellen) innehaben. Daher wird nun ernsthaft über ihr Potenzial als neuroprotektive Wirkstoffe nachgedacht. Cannabinoide können nachweislich den Tod von Nervenzellen bei akuten neuronalen Verletzungen verhindern, unter anderem bei ischämischen Schlaganfällen und traumatischen Hirnverletzungen, und sie bewirken auch eine Milderung der Symptome bei Multipler Sklerose, der Huntington-Krankheit sowie bei anderen chronischen neurodegenerativen Erkrankungen.
Sowohl in Vitro (im Reagenzglas) als auch in Vivo (in lebenden Organismen) gesammelte Daten legen nahe, dass die Endocannabinoid-Rezeptoragonisten Anandamid und 2-AG ebenso wie diverse synthetische Cannabinoide und Phyto-Cannabinoide bei traumatischen Hirnverletzungen (TBI = Traumatic Brain Injury) neuroprotektive Wirkungen besitzen. Es ist allgemein bekannt, dass eine TBI zur Freisetzung schädlicher Stoffe führt, die sekundäre Hirnschäden verursachen; jetzt haben Forscher herausgefunden, dass auch neuroprotektive Mittlerstoffe frei werden und dass das Ausmaß der Schädigung letztlich von der Balance zwischen den beiden Stoffkategorien abhängt.
Hemmung der schädlichen Stoffe
Eine 2002 veröffentlichte Studie (Mechoulem et al) zeigte, dass die Produktion von Anandamid und 2-AG im Gehirn nach einer TBI anstieg und dass die Produktion der Substanzen, die bekanntermaßen neurale Schäden hervorrufen—Tumornekrosefaktor-a und reaktive Sauerstoffspezies (ROS)—durch deren Anwesenheit gehemmt wurde. Man vermutet, dass das Endocannabinoidsystem bei der Hemmung der Freisetzung von Neurotransmittern wie Glutamat (der Haupttransmitter bei der glutamatergen synaptischen Transmission, dem bei der Regulierung der Nervenimpulse sowie bei kognitiven Funktionen wie Lernen und Gedächtnis eine große Bedeutung zukommt) ebenso wie bei der Regulierung der Entzündungsreaktion in diesem Zusammenhang eine wichtige Rolle spielt.
Verschiedene weitere Studien haben diese Ergebnisse bestätigt. Eine andere von Mechoulam et al im Jahr 2002 veröffentlichte Studie bewies, dass auch bei Mäusen und Ratten die endogenen Konzentrationen von Anandamid und 2-AG infolge einer TBI anstiegen; wenn beide Substanzen nach der TBI verabreicht wurden, konnte das Ausmaß der Gehirnschäden vermindert werden. Man registrierte eine Verminderung der Hirnödeme (Flüssigkeitsansammlung, die zu einer Schwellung führt) sowie ein geringeres Ausmaß des Hirninfarkts (Umfang der Gewebsnekrose) und stellte zudem fest, dass im Hippocampus weniger Zellen absterben und dass die klinische Genesung der Tiere generell verbessert wurde.
2-AG kann der Verengung der Blutgefäße entgegenwirken
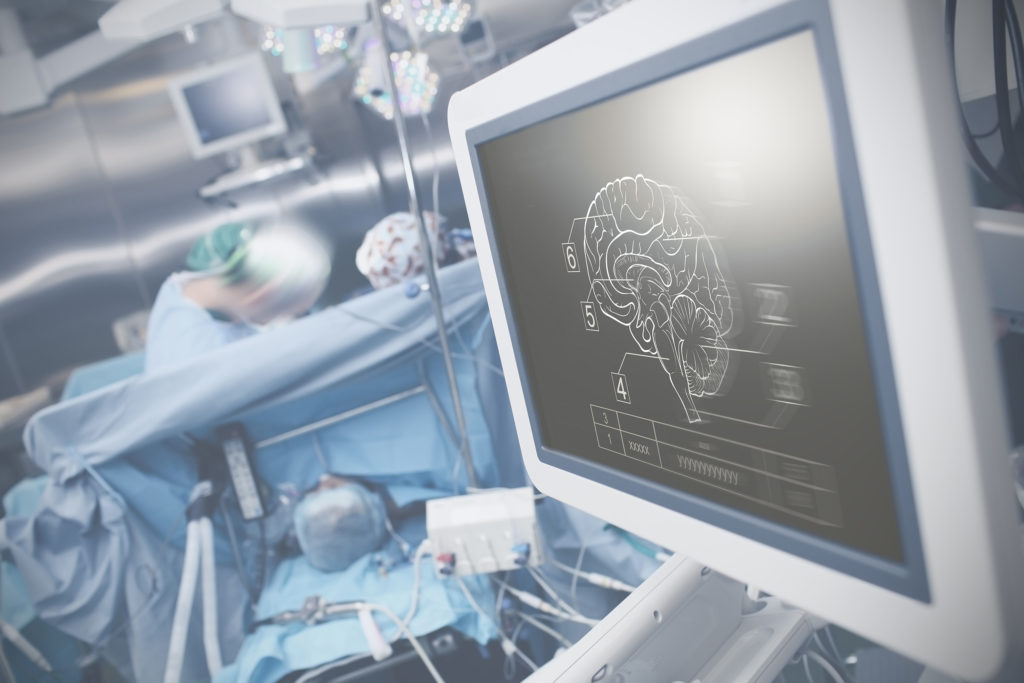 Traumatische Hirnverletzungen führen häufig zum Tod, aber auch zu dauerhaften neurologischen Komplikationen
Traumatische Hirnverletzungen führen häufig zum Tod, aber auch zu dauerhaften neurologischen Komplikationen
Außerdem fand man heraus, dass 2-AG effektiver war, wenn es mit ähnlichen Stoffen der Fettsäureglycerinester-Gruppe verabreicht wurde. Man weiß, dass 2-AG eine erhebliche Bedeutung bei der Gefäßregulierung hat, was seine Effektivität nach einer TBI erhöhen könnte — indem es der Blutgefäßverengung entgegenwirkt, die durch die Freisetzung von Endothelinen (Verbindung aus 21 Aminosäuren, die potentesten Gefäßverengungsstoffe, die man kennt) bewirkt wird. Es kann dabei helfen, die Durchblutung der betroffenen Stelle wiederherzustellen. Dieser Zusammenhang deckt sich auch mit der These einer Balance zwischen schädlichen und hilfreichen Stoffen, die letztlich über den Ausgang einer TBI entscheidet.
Die Fülle der vorliegenden Beweise hat die Grundlage für mehrere klinische Studien geliefert, die neurodegenerative Erkrankungen und neuronale Verletzungen sowie deren Reaktion auf Cannabinoidverbindungen untersuchen. Doch unser Verständnis der komplexen Beziehung zwischen dem Endocannabinoidsystem und den verschiedenen anderen Übertragungssystemen des Körpers ist ziemlich lückenhaft und muss noch erheblich verbessert werden, wenn wir das neuroprotektive Potenzial der Endocannabinoide nach einer TBI effektiv nutzen wollen.
Einsatz von Cannabinoiden zur Genesung nach einem Schlaganfall
In mehreren Studien wurde bewiesen, dass THC, CBD und verschiedene andere Cannabinoide während und nach dem Auftreten eines ischämischen Schlaganfalls (IS) bzw. Hirninfarkts eine neuroprotektive Wirkung ausüben. Zwar gab es in einigen anderen Studien Anzeichen dafür, dass Cannabiskonsum das Risiko eines Schlaganfalls erhöhen kann, aber offensichtlich ist dieses Phänomen auf eine kleine Untergruppe von hierfür empfänglichen Personen beschränkt. Bei der Mehrheit der Menschen scheinen Cannabinoidtherapien in der Lage zu sein, Entzündungen und oxidativen Stress aufgrund eines IS erheblich zu mindern.
Vor allem CBD ist im Hinblick auf seine neuroprotektive Fähigkeit bei IS ausführlich erforscht worden. Dabei hat sich herausgestellt, dass es die Durchblutung des Gehirns nach einem IS erhöht und hierdurch das Ausmaß des Infarkts abschwächt; im Gegensatz zu THC, das bei mehrfachen Dosierungen eine Tendenz zu geringerer Effektivität zeigt, bleibt CBD selbst dann noch wirksam, wenn es vierzehn Tage lang mehrmals verabreicht wird. Aus diesem Grund wird ihm in diesem Forschungsbereich ein größeres therapeutisches Potenzial bescheinigt als THC. Außerdem kann CBD nachweislich Entzündungen vermindern, die durch die Freisetzung von Interleukin-1, Stickoxid und Tumornekrosefaktor-a als Folge eines IS verursacht werden.
Wie bei einer TBI ist ein Großteil der Schäden durch einen IS auf oxidativen Stress zurückzuführen, der durch eine Anhäufung der ROS aufgrund der exzessiven glutamatergen Neurotransmission hervorgerufen wird. Sowohl THC als auch CBD haben sich als effektive Antioxidanzien erwiesen, die die glutamaterge Neurotransmission hemmen und hierdurch das Ausmaß der Anhäufung der ROS infolge eines ischämischen Schlaganfalls reduzieren; allerdings zeigt sich auch hier, dass CBD ein effektiveres Antioxidans ist als THC und somit größeres therapeutisches Potenzial besitzt.
Der Neurotransmitter Glutamat und die Cannabinoide
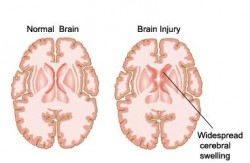 Hirnschäden infolge akuter Erkrankungen wie eines IS oder einer TBI sind teilweise auf Entzündungen zurückzuführen (Mahesh Kumar)
Hirnschäden infolge akuter Erkrankungen wie eines IS oder einer TBI sind teilweise auf Entzündungen zurückzuführen (Mahesh Kumar)
Die Interaktionen zwischen verschiedenen Cannabinoiden und dem glutamatergen Signalsystem wurden in einer Studie mit dem Titel Neuroprotective Antioxidants from Marijuana (= Neuroprotektive Antioxidanzien aus Marihuana), die im Jahr 2000 veröffentlicht wurde, eingehend untersucht. In dieser Studie untersuchte man Cannabidiol und mehrere andere Cannabinoide im Hinblick auf ihr neuroprotektives Potenzial in Vitro in Neuronenkulturen von Ratten, die toxischen Glutamatkonzentrationen ausgesetzt waren.
Es ist bekannt, dass hohe Glutamatkonzentrationen Neurotoxizität auslösen (die besonders durch NMDA-, AMPA- und Kainat-Glutamatrezeptoren herbeigeführt wird) und für die Bildung sekundär schädlicher Substanzen wie ROS und des Tumornekrosefaktors-a verantwortlich sind. Man weiß auch, dass die Aktivität von Glutamat durch die Anwesenheit von Antioxidanzien reduziert wird; und da CBD und THC wohlbekannte Antioxidanzien sind, verfügte man nun über eine klare Grundlage für die weitere Erforschung der Cannabinoide.
Ein von Cannabinoidrezeptoren unabhängiger Mechanismus
Die Forschung wies nach, dass sowohl THC als auch CBD die Neuroprotektion erhöhten und die Neurotoxizität der NMDA-, AMPA- und Kainat-Rezeptoren verminderten. Darüber hinaus wurde der Grad der Neuroprotektion nicht durch die Aktion von spezifischen Cannabinoidrezeptorantagonisten erhöht, was darauf hindeutet, dass der Aktionsmechanismus nicht von Cannabinoidrezeptoren abhängig war. Frühere Studien kamen zu dem Schluss, dass Cannabinoidrezeptoragonisten für das Zustandekommen der Neuroprotektion entscheidend seien; doch da Cannabidiol kein Agonist ist, muss sein neuroprotektives Potenzial woanders verwirklicht werden.
Außerdem wurde gezeigt, dass CBD die Toxizität von Hydroperoxid (ein Typ der ROS) in Neuronenzellkulturen vermindert – was seine Effektivität als Antioxidans zusätzlich bestätigte. Die Fähigkeit von CBD zur Verminderung der Toxizität wurde in einem Test mit zwei anderen bekannten Antioxidanzien verglichen, A-Tocopherol (Vitamin E) und Ascorbat (Salz der Ascorbinsäure Vitamin C), wobei sich CBD gegenüber beiden Substanzen im Hinblick auf die neuroprotektive Kapazität als überlegen erwies. Zwar wurden diese Tests in Vitro durchgeführt, aber vorausgehende in Vivo- Studien über ischämische Schlaganfälle bei Ratten deuten darauf hin, dass die Effektivität von CBD alle Bereiche umfasst.
Der perinatale hypoxisch-ischämische Insult
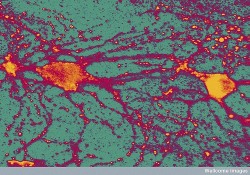 Es ist erwiesen, dass CBD die Neuronen des Hippocampus vor der Zerstörung durch eine Hirnverletzung schützt (Wellcome Images)
Es ist erwiesen, dass CBD die Neuronen des Hippocampus vor der Zerstörung durch eine Hirnverletzung schützt (Wellcome Images)
Der perinatale hypoxisch-ischämische Insult (Durchblutungsstörung) ist eine wichtige Ursache von Gehirnschäden bei Neugeborenen – verantwortlich dafür ist eine oftmals während der Geburt auftretende Asphyxie, bei der die Blut- und Sauerstoffversorgung des Gehirns des Säuglings unterbrochen wird. Diese verheerende Komplikation führt bei 15-20 % der Kinder mit dieser Diagnose zum Tod und bei weiteren 25 % zu schweren neurologischen Schäden – unter anderem Epilepsie, zerebrale Kinderlähmung, Bewegungsstörungen und Hyperaktivität. Im Entwicklungsstadium ist das Gehirn weit anfälliger für hypoxisch-ischämische Schädigungen als das Gehirn eines Erwachsenen, da es eine hohe Konzentration an Blutgefäßen und mehr Wasser enthält, und somit besteht eine größere Gefahr, dass schädigende Ereignisse wie zum Beispiel schwere Blutungen stattfinden.
Nachdem ein hypoxisch-ischämischer Gehirnschaden aufgetreten ist, wird sofort eine Reihe von spezifischen Zellmechanismen einschließlich einer erhöhten Glutamatproduktion in Gang gesetzt, was zur Schädigung der Zellen und schließlich zur Excitotoxizität führt (ein Typ des Zelltods, der durch eine exzessive glutamaterge Transmission hervorgerufen wird). Wie dieser Prozess genau abläuft, ist noch nicht vollständig verstanden worden, was an der Komplexität der dieser Störung zugrunde liegenden molekularen Mechanismen liegt; daher mangelt es an effektiven Behandlungsmöglichkeiten zur Linderung der neuronalen Schäden. Inzwischen hat die Forschung auf diesem Gebiet jedoch rapide Fortschritte erzielt, und das hat zu einer neuen Kategorie von neuroprotektiven Therapien geführt, die bewertet und angewandt werden müssen, wenn sie sich als wirksam erwiesen haben.
Der Einsatz von Cannabinoidtherapien bei Kindern
Unter anderem wird hierbei auch das Endocannabinoidsystem erforscht, um dessen spezifische Rolle bei der Neuroprotektion des Gehirns im Entwicklungsstadium zu ermitteln. Der Einsatz von Cannabinoidtherapien bei Kindern ist zwar nach wie vor umstritten, doch es gab bereits genügend Erfolge aufgrund der Anwendung von Cannabinoiden bei verschiedenen Kinderkrankheiten (einschließlich Epilepsie und Krebs) – ohne nachteilige Nebenwirkungen -, sodass sich in wissenschaftlichen Kreisen nun zunehmend die Meinung durchsetzt, dass solche Therapien hilfreich sein können.
So wurde gezeigt, dass Cannabinoide nicht nur neuronale Reaktionen, sondern auch die Vasodilation (Blutgefäßerweiterung) aufgrund der Funktion der Endothelzellen und der Aktivität der Endotheline regulieren. Außerdem beeinflussen sie die Calcium-Homöostase (Calcium-Stoffwechsel) und besitzen erhebliche anti-excitotoxische und entzündungshemmende Wirkungen. Darüber hinaus gibt es Anzeichen dafür, dass bestimmte entzündungshemmende Behandlungen tatsächlich die Genesung unterstützen können, indem sie die Neurogenese (Bildung neuer Neuronen bzw. Nervenzellen) fördern. Deshalb ist die Nutzung des Potenzials des Endocannabinoidsystems eine wichtige neuroprotektive Strategie zur Behandlung des hypoxisch-ischämischen Gehirns eines Neugeborenen, und noch dazu eine, die offenbar ein sehr geringes Risiko von negativen Nebenwirkungen hat.
Die antioxidativen und regulierenden Eigenschaften der Cannabinoide, insbesondere ihre Fähigkeit zur Hemmung der Glutamatfreisetzung und anderer schädigender Stoffe wie Stickstoffmonoxid, machen diese Substanzen vor allem als Schutz vor der fortschreitenden Schädigung des hypoxisch-ischämischen Gehirns attraktiv. Denn es ist bekannt, dass glutamaterge Excitotoxizität ebenso wie die Toxizität von Stickstoffmonoxid und oxidativer Stress entscheidende Faktoren des perinatalen hypoxisch-ischämischen Gehirnschadens sind.
Effektivität der synthetischen Cannabinoide
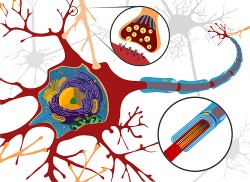 Man nimmt an, dass Cannabinoide durch ihre Beteiligung an der glutamatergen Transmission an den Synapsen einen schützenden Effekt ausüben (Ethan Hein)
Man nimmt an, dass Cannabinoide durch ihre Beteiligung an der glutamatergen Transmission an den Synapsen einen schützenden Effekt ausüben (Ethan Hein)
Heute widmet sich die Forschung nicht nur Endocannabinoiden und Phyto- (pflanzlichen) Cannabinoiden, sondern auch dem Potenzial verschiedener synthetischer Cannabinoide. Beispielsweise ergab eine Studie, die 1999 im Journal of Neuroscience veröffentlicht wurde, dass der synthetische Cannabinoidagonist R(+)-WIN 55212-2 den Neuronenverlust im Hippocampus in Vivo infolge eines globalen ischämischen Schlaganfalls (Durchblutungsstörung des gesamten Gehirns) bei Ratten verminderte und zudem das Ausmaß des Infarktes infolge eines fokalen ischämischen Schlaganfalls reduzierte, der durch den Verschluss der mittleren Hirnarterie ausgelöst worden war.
Das weniger aktive Enantiomer (das sog. “Spiegelbild-” Molekül) S(-)-WIN 55212-3, wurde für ineffektiv befunden, und der schützende Effekt des R(+)-WIN 55212-2 wurde offenbar durch die Aktion eines spezifischen CB1-Rezeptorantagonisten blockiert, der den folgenden, überlangen Namen trägt: N-(Piperidin-1-yl)-5-(4-Chlorophenyl)-1-(2,4-Dichlorophenyl)-4-Methyl-1H-Pyrazol-3-Carboxamid-Hydrochlorid.
Interessanterweise lieferten die in Vivo- und die in Vitro- Studien unterschiedliche Ergebnisse. In Vitro zeigte R(+)-WIN 55212-2 noch einen schützenden Effekt auf die Neuronen, doch der Effekt wurde nicht durch Antagonisten blockiert. Dieses Gebiet muss noch viel intensiver erforscht werden, um zu ermitteln, welche Interaktionen hier im Einzelnen am Werk sind. Aber bereits heute steht fest, dass diese und andere synthetische Cannabinoide potenzielle Anwendungsmöglichkeiten zur Behandlung des (ischämischen) Schlaganfalls bieten.
Cannabinoide besitzen nachweislich neuroprotektive Eigenschaften
 Cannabinoide können Gehirnschäden lindern, die durch hypoxisch-ischämische Durchblutungsstörungen bei Neugeborenen hervorgerufen werden. Diese stellen eine maßgebliche Ursache für Entwicklungsstörungen bei Kindern dar. (Godverbs)
Cannabinoide können Gehirnschäden lindern, die durch hypoxisch-ischämische Durchblutungsstörungen bei Neugeborenen hervorgerufen werden. Diese stellen eine maßgebliche Ursache für Entwicklungsstörungen bei Kindern dar. (Godverbs)
Inzwischen verfügen wir über eine Fülle von Beweisen, die die Effektivität der Phyto-Cannabinoide – insbesondere von CBD – bei der Bewältigung und Linderung von traumatischen Hirnverletzungen und ischämischen Schlaganfällen anzeigen. Darüber hinaus verbessert sich unser Verständnis der Funktion der endogenen Cannabinoide Anandamid und 2-AG bei der Regulierung von Entzündungen und Durchblutungsstörungen des Gehirns fortwährend, und damit wächst auch unsere Fähigkeit, gezielt synthetische Cannabinoide herzustellen, die die Aktionen dieser Endocannabinoide präzise nachahmen können.
Selbstverständlich wartet noch eine Unmenge von Wissen darauf, von uns entdeckt zu werden, aber in letzter Zeit hat die Forschung immer mehr Erkenntnisse in immer kürzerer Zeit gewonnen. Angesichts dieses Tempos ist es durchaus wahrscheinlich, dass zielgerichtete neuroprotektive Therapien zur Linderung der Schäden, die durch traumatische Hirnverletzungen und ischämische Schlaganfälle verursacht werden, schon in wenigen Jahren weitverbreitet sein werden.

